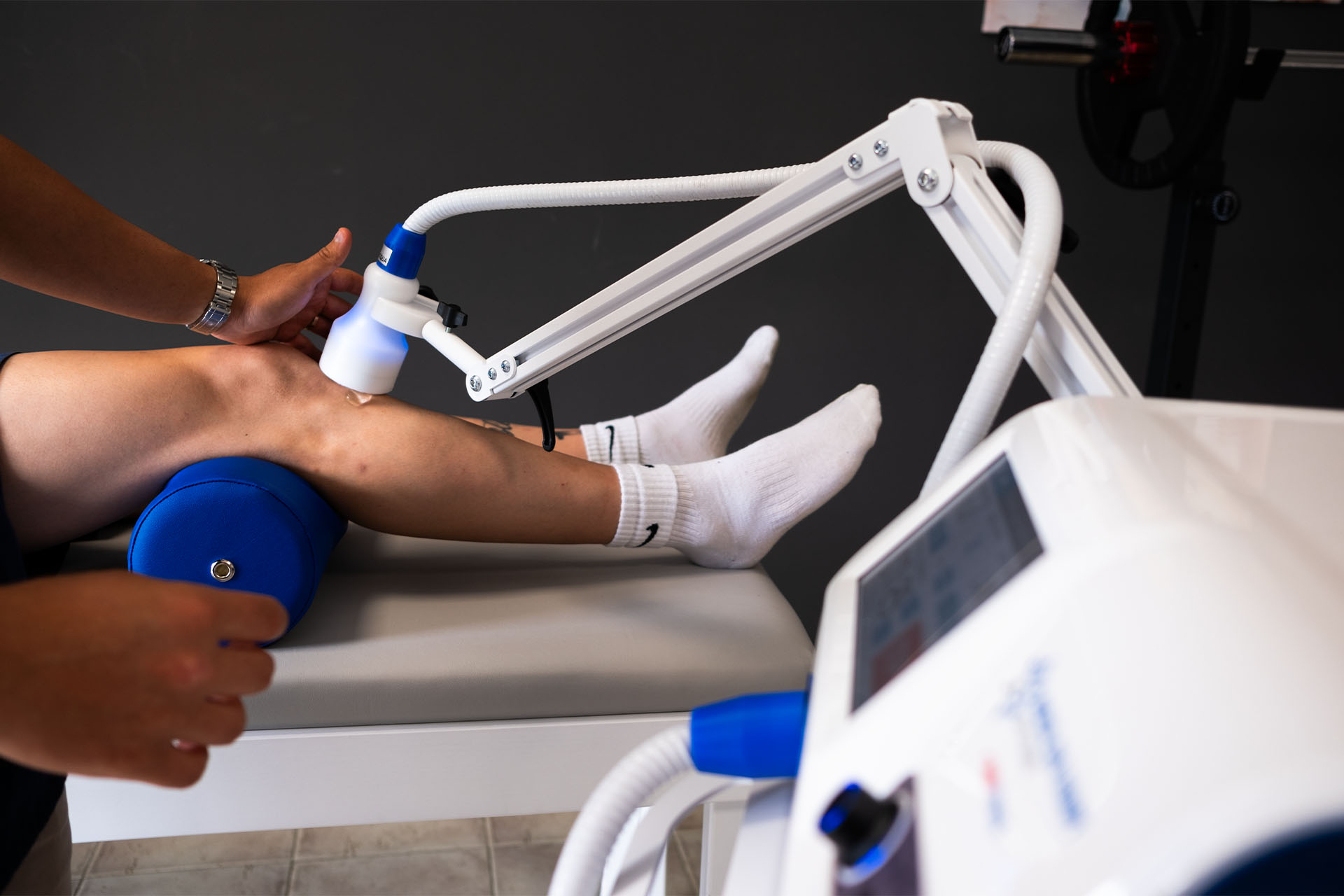
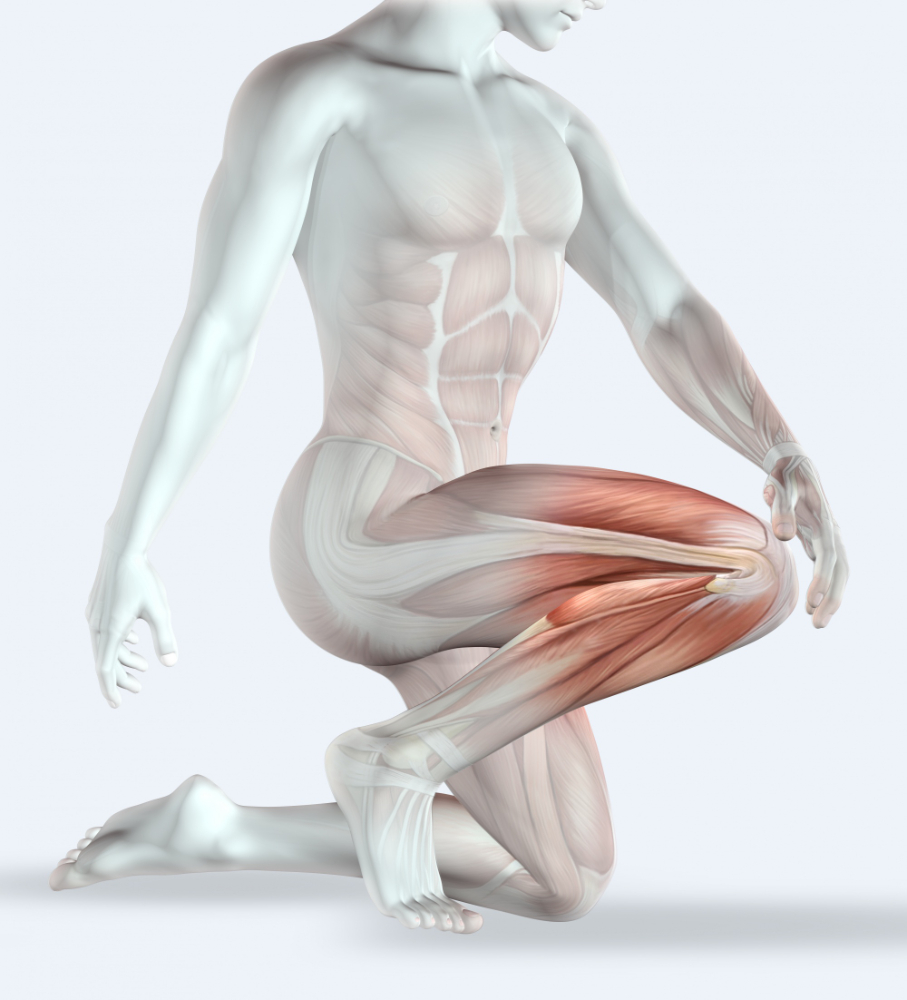
Czym jest tendinopatia i jakich ścięgien najczęściej dotyczy?

Częstość występowania tendinopatii w diagnozach schorzeń narządu ruchu oceniana jest jako wysoka. Najczęściej występujące tendinopatie dotyczą ścięgna Achillesa, okolicy rzepki oraz ścięgien stożka rotatorów [1]. Liczbę zachorowań na tendinopatię w obszarze stożka rotatorów szacuje się na ponad 1% w skali roku, a podatność na jej występowanie rośnie wraz z wiekiem[2,3]. W starszym wieku rośnie także częstość przeprowadzania operacji tego obszaru [4]. Inne znane tendinopatie to łokieć golisty czy łokieć tenisisty, a także tendinopatie ścięgien okolicy nadgarstka [5].
Etologia tendinopatii
Patogeneza tendinopatii jest wieloczynnikowa [5,6]. Wraz z wiekiem rośnie ryzyko wystąpienia schorzeń o charakterze tendinopatii [7,8]. Jako mechanizmy negatywnie wpływające na ścięgna i skutkujący zwiększonym ryzykiem wystąpienia tendinopatii wskazuje się także stres i nakładające się przeciążenia danego obszaru układu ruchu, czyli wielokrotne powtarzanie tej samej czynnosci [7,9]. Inną grupą czynników ryzyka jest brak aktywności fizycznej i ciągłe odciążenie struktur ścięgnistych, co negatywnie wpływa na homeostazę kolagenową ścięgien [10]. W badaniach wykazano także wpływ wysokiego poziomu cholesterolu oraz zdiagnozowanej cukrzycy na zwiększone ryzyko wystąpienia tendinopatii [11,12]. Niekorzystny wpływ na stan ścięgien mają również zburzenia równowagi metaboliczno-hormonalnej [13].
Historyczne spojrzenie na przyczyny tendinopatii
W roku 1934 roku Codman sądził, że degeneracja ścięgien była oparta na działaniu mechanizmów „wewnętrznych” [14]. Inny punkt widzenia przedstawiał Neer, który prezentował teorię znaczenia czynników „zewnętrznych”. Aktualne, nowoczesne, spojrzenie na problem tendinopatii obejmuje zarówno wpływ czynników wewnętrznych jak i zewnętrznych [15].
Patogeneza choroby
Tendinopatia ma charakterystyczne cechy histopatologiczne oraz kliniczne [16]. W obrazie histopatologicznym wyróżnia się dezorganizację kolagenu oraz zwiększone odkładanie substancji podstawowej i związane z nimi zmiany w wyglądzie komórek [17,18]. Błędnie określa się, w wielu opracowaniach, tendinopatię jako zapalenie ścięgna. Jest to bowiem połączenie teorii zwyrodnieniowej („tendinoza”) oraz etiologii zapalnej („zapalenie ścięgna”) [19]. Aktualne dowody wskazują na obecność zarówno zmian komórkowych, wskazujących na zmiany zwyrodnieniowe ścięgna, oraz wzrost markerów stanu zapalenie i degradację macierzy, charakterystyczne dla zapalenia [20].
Objawy kliniczne a wynik badań diagnostycznych
Objawy tendinopatii bardzo często nie są ściśle powiązane z wynikami badań histopatologicznych oraz radiologicznych. Oznacza to, że liczna grupa pacjentów z degeneracją w obrębie ścięgna, widoczną w obrazowaniu diagnostycznym, nie będzie odczuwało żadnych objawów choroby [21]. Badania wskazują na obecność bólu w przebiegu tendinopatii jako efekt reakcji komórek i nerwów obwodowych na zmianę zwyrodnieniową. Oznacza to, że pojawienie się zmian zwyrodnieniowych nie wywołuje zawsze objawów. O tym czy objawy się pojawią czy nie decyduje reakcja otaczających komórek na obecność zwyrodnienia. Aktywacja szlaków nocyceptywnych wywołuje objawy choroby. W sytuacji, w której dochodzi do zerwania ścięgna, okazuje się z kolei, że w 97% przypadków występują zmiany histologiczne [22].
W najnowszych badaniach wskazuje się na rolę glutaminianu w występowaniu objawów tendinopatii. Glutaminian jest aminokwasem zaangażowanym w procesy fizjologiczne w organizmie, między innymi metabolizm komórkowy, wrażliwość bólową oraz syntezę kolagenu [23,24]. Wykazano, że obecność glutaminianu w okolicy ścięgna wywołuje ból oraz przeczulicę tkanki [25]. Udowodniono jednocześnie obecność glutaminianu w przebiegu bolesnej tendinopatii ścięgna Achillesa [26]. Potwierdzono także, że w rotatorach występuje zwiększona regulacja układu glutaminergicznego [27]. Badania histologiczne oraz immunohistochemiczne wykazały wzrost barwienia glutaminianem w ścięgnach stożka rotatorów objętych zmianami komórkowymi typowymi dla tendinopatii [28].
Jednocześnie wskazuje się istotną rolę glutaminianu w normalnym procesie gojenia ścięgien, podczas gdy w tendinopatii wydaje się negatywnie wpływać na proces leczenia [29]. Innym elementem podlegającym ocenie naukowców była reakcja ścięgien na działanie leków przeciwzapalnych [30]. Wykazano krótkotrwałe, pozytywne efekty ich stosowania. Nie obserwuje się jednak skuteczności długoterminowej [31]. Brak efektywnych metod leczenia wynika z nie do końca poznanego mechanizmu zmian, które w niektórych opracowaniach oceniane są jako zmiany zapalne, w innych zaś jedynie jako efekt degeneracji ścięgien, w przebiegu zwyrodnienia [32,33]. Wciąż trwają rozważania nad skuteczną formą terapii przewlekłej tendinopatii.
Charakterystyczne objawy tendinopatii
Do typowych objawów tendinopatii należy ból, któremu towarzyszy obrzęk oraz, wynikające z niego, ograniczenie ruchomości. Objawy nasilają się na skutek wykonywanej aktywności fizycznej angażującej mięśnie, w ścięgnach których pojawiły się zmiany o charakterze tendinopatii. Jak wyżej wspomniano objawy nie zawsze związane są z wynikiem badania obrazowego. Zmiany widoczne w obrazowaniu diagnostycznym często nie dają objawów. Warto w terapii kierować się więc dokładnym wywiadem oraz badaniem przedmiotowym pacjenta.
Metody leczenia
Dokładne mechanizmy powstawania tendinopatii nie zostały do końca poznane. Istnieje szereg teorii, z których niektóre zostały przytoczone w niniejszym opracowaniu. Leczenie krótkoterminowe obejmuje więc ograniczenie stanu zapalnego poprzez podanie leków przeciwbólowych oraz stosowanie fizykoterapii w formie krioterapii, fonoforezy, laseru czy terapii polem magnetycznym.Zaleca się także terapię manualną oraz terapię tkanek miękkich mające na celu zapobieganie zrostom pozapalnym oraz przywrócenie prawidłowej pracy ścięgien i otaczających tkanek. W terapii długofalowej niezbędne jest zastosowanie odpowiednio dobranych ćwiczeń fizycznych, a w fazie ostrej ograniczenie aktywności wywołujących ból. Niezbędna jest także edukacja pacjenta w kierunku odpowiedniego użytkowania kończyny objętej procesem chorobowym.
Bibliografia:
1. Wilson JJ, Best TM. Common overuse tendon problems: a review and recommendations for treatment. Am Fam Phys Sep 1 2005;72(5):811-8.
2. Littlewood C, May S, Walters S. Epidemiology of rotator cuff tendinopathy: a systematic review.Shoulder Elb 2013;5(4):256-65.
3. Teunis T, Lubberts B, Reilly BT, Ring D. A systematic review and pooled analysis of the prevalence of rotator cuff disease with increasing age. J Shoulder Elb Surgery/Am Shoulder Elb Surg Dec 2014;23(12):1913-21.
4. Paloneva J, Lepola V, Aarimaa V, Joukainen A, Ylinen J, Mattila VM. Increasing incidence of rotator cuff repairseA nationwide registry study in Finland. BMC Musculoskelet Disord Aug 12 2015;16:189.
5. Xu Y, Murrell GA. The basic science of tendinopathy. Clin Orthop Relat Res Jul 2008;466(7):1528-38.
6. Riley G. The pathogenesis of tendinopathy. A molecular perspective. Rheumatology (Oxford) Feb 2004;43(2):131-42.
7. de Jonge S, van den Berg C, de Vos RJ, et al. Incidence of midportion Achilles tendinopathy in the general population. Br J Sports Med Oct 2011;45(13):1026-8.
8. Tashjian RZ. Epidemiology, natural history, and indications for treatment of rotator cuff tears. Clin Sports Med Oct 2012;31(4):589-604.
9. Heir T, Glomsaker P. Epidemiology of musculoskeletal injuries among Norwegian conscripts undergoing basic military training. Scand J Med Sci Sports Jun 1996;6(3):186-91.
10. Dideriksen K, Boesen AP, Reitelseder S, et al. Tendon collagen synthesis declines with immobilization in elderly humans: no effect of anti-inflammatory medication. J Appl Physiol Bethesda Md 1985 Feb 01 2017;122(2):273-82.
11. Tilley BJ, Cook JL, Docking SI, Gaida JE. Is higher serum cholesterol associated with altered tendon structure or tendon pain? A systematic review. Br J Sports Med Dec 2015;49(23):1504-9.
12. Ranger TA, Wong AM, Cook JL, Gaida JE. Is there an association between tendinopathy and diabetes mellitus? A systematic review with meta-analysis. Br J Sports Med Aug 2016;50(16):982-9. 13. Oliva F, Piccirilli E, Berardi AC, Frizziero A, Tarantino U, Maffulli N. Hormones and tendinopathies: the current evidence. British Medical Bulletin Mar 2016;117(1):39-58
14. Codman EA, Akerson IB. The pathology associated with rupture of the supraspinatus tendon. Ann Surg Jan 1931;93(1):348-59.
15. Papadonikolakis A, McKenna M, Warme W, Martin BI, Matsen 3rd FA. Published evidence relevant to the diagnosis of impingement syndrome of the shoulder. J Bone Joint Surg Am Oct 5 2011;93(19):1827-32.
16. Riley G. Tendinopathyefrom basic science to treatment. Nat Clin Pract Rheumatol Feb 2008;4(2):82-9.
17. Dean BJ, Franklin SL, Carr AJ. A systematic review of the histological and molecular changes in rotator cuff disease. Bone Joint Res Jul 2012;1(7):158-66.
18. Khan KM, Cook JL, Bonar F, Harcourt P, Astrom M. Histopathology of common tendinopathies. Update and implications for clinical management. Sports Med Auckland NZ Jun 1999;27(6):393-408.
19. Dean BJ, Gettings P, Dakin SG, Carr AJ. Are inflammatory cells increased in painful human tendinopathy? A systematic review. Br J Sports Med Feb 2016;50(4):216-20.
20. Thorpe CT, Chaudhry S, Lei II , et al. Tendon overload results in alterations in cell shape and increased markers of inflammation and matrix degradation. Scand J Med Sci Sports Aug 2015;25(4):e381-391.
21. Yamaguchi K, DK, Middleton WD, Hildebolt CF, Galatz LM, Teefey SA. The demographic and morphological features of rotator cuff disease. A comparison of asymptomatic and symptomatic shoulders. JBJS (Am) 2006;88(8):1699-704.
22. Kannus P, Jozsa L. Histopathological changes preceding spontaneous rupture of a tendon. A controlled study of 891 patients. J Bone Joint Surg Am Dec 1991;73(10):1507-25.
23. Dean BJ, Gwilym SE, Carr AJ. Why does my shoulder hurt? A review of the neuroanatomical and biochemical basis of shoulder pain. Br J Sports Med Nov 2013;47(17):1095-104.
24. Newsholme P, Procopio J, Lima MM, Pithon-Curi TC, Curi R. Glutamine and glutamateetheir central role in cell metabolism and function. Cell Biochem Funct Mar 2003;21(1):1e9.
25. Gibson W, Arendt-Nielsen L, Sessle BJ, Graven-Nielsen T. Glutamate and capsaicin-induced pain, hyperalgesia and modulatory interactions in human tendon tissue. Exp Brain Res Exp Hirnforschung Exp Cereb Apr 2009;194(2):173-82.
26. Alfredson H, Thorsen K, Lorentzon R. In situ microdialysis in tendon tissue: high levels of glutamate, but not prostaglandin E2 in chronic Achilles tendon pain. Knee Surg Sports Traumatol Arthrosc 1999;7(6):378-81.
27. Franklin SL, Dean BJ, Wheway K, Watkins B, Javaid MK, Carr AJ. Up-regulation of glutamate in painful human supraspinatus tendon tears. Am J Sports Med May 28 2014;42(8):1955-62.
28. Scott A, Alfredson H, Forsgren S. VGluT2 expression in painful Achilles and patellar tendinosis: evidence of local glutamate release by tenocytes. J Orthop Res Off Publ Ortho Res Soc May 2008;26(5):685-92.
29. Greve K, Domeij-Arverud E, Labruto F, et al. Metabolic activity in early tendon repair can be enhanced by intermittent pneumatic compression. Scand J Med Sci Sports Aug 2012;22(4):e55-63.
30. Millar NL, Dean BJ, Dakin SG. Inflammation and the continuum model: time to acknowledge the molecular era of tendinopathy. Br J Sports Med Jun 3 2016. http://dx.doi.org/ 10.1136/bjsports-2016-096419.
31. Gaujoux-Viala C, Dougados M, Gossec L. Efficacy and safety of steroid injections for shoulder and elbow tendonitis: a metaanalysis of randomised controlled trials. Ann Rheum Dis Dec 2009;68(12):1843-9.
32. Freedman BR, Gordon JA, Soslowsky LJ. The Achilles tendon: fundamental properties and mechanisms governing healing. Muscles Ligaments Tendons J Apr 2014;4(2):245-55.
33. Millar NL, Murrell GA, McInnes IB. Inflammatory mechanisms in tendinopathy e towards translation. Nat Rev Rheumatol Jan 25 2017;13(2):110-22.