Efekty nowego rodzaju fali uderzeniowej (Diamagnetyczna fala uderzeniowa) w leczeniu artrozy kciuka:
Autor korespondujący: Pietro Romeo, Instytut Ortopedyczny Galeazzi, Milano, Włochy
Cytat: Visconti S, Torres F, Cuko G, Di Pardo F, Gosetti1 R, et al. (2021) The Effects of a Novel Type of Shock Wave (Diamag- netic Shock Wave) in the Treatment of the Osteoarthrosis of the Thumb: Studium serii przypadków i spojrzenie na bezbolesną mechanoterapię. J Orthop Res Ther 6: 1186. DOI: 10.29011/2575-8241.001186
Data wpłynięcia: 22 lutego 2021 r.; Data akceptacji: 26 lutego 2021 r.; Data publikacji: 05 marca 2021 r
Streszczenie
W praktyce terapeutycznej pozaustrojowe fale uderzeniowe (ESW) są znane ze swojego działania przeciwzapalnego, antyalgicznego i regeneracyjnego. Z tego powodu są one z powodzeniem stosowane w większości schorzeń układu mięśniowo-szkieletowego, w tym w chorobie zwyrodnieniowej stawów (OA). Przedstawiamy serię przypadków 66 kolejnych pacjentów cierpiących na osteoartrozę kciuka (T-OA) sklasyfikowaną w II-III stadium radiologicznym Eatona i Littera i leczonych nowym typem pozaustrojowego urządzenia do fal uderzeniowych (CTU-S- Wave). Urządzenie generuje mechaniczne fale uderzeniowe, wykorzystując odpychające zjawisko diamagnetyzmu, które opiera się na efektach, jakie impulsowe pola elektromagnetyczne o wysokiej intensywności i niskiej częstotliwości (HI-LF-PEMF) wywierają na materiały diamagnetyczne, takie jak grafit, bizmut i inne. Z tego odpychającego efektu powstaje tak zwana diamagnetyczna fala uderzeniowa. Głównym celem naszego badania była ocena skuteczności ESW na ból przed i po zabiegu. Następnie oceniliśmy ewentualny dyskomfort pacjentów pod względem odczuwanego bólu w wyniku stymulacji kości podchrzęstnej pierwszego stawu nadgarstkowo-śródręcznego, przypisywanej mechanicznej fali uderzeniowej. Wszyscy pacjenci zgłosili dobrą zgodność z leczeniem, łagodząc pierwotny ból spowodowany artrozą (p < 0,001), podczas gdy zgłaszano jakikolwiek dyskomfort. Diamagnetyczna fala uderzeniowa okazała się skutecznym i całkowicie bezbolesnym leczeniem.
Słowa kluczowe: Diamagnetic; Pozaustrojowe fale uderzeniowe; Mechanoterapia; Osteoartroza kciuka
Wprowadzenie
Osteoartroza kciuka jest wieloczynnikową, wyniszczającą chorobą ręki i stanowi drugą najczęstszą lokalizacja choroby zwyrodnieniowej stawów , przeważającą u kobiet w wieku pomenopauzalnym [1]. Przebieg kliniczny charakteryzuje się postępującą utratą funkcji chwytnej i stopniowo upośledza sprawność ręki w zwykłych czynnościach życiowych [2]. Oprócz czynników genetycznych, metabolicznych, hormonalnych i biomechanicznych, ten wielofunkcyjny staw może być narażony na konsekwencje nadużywania i ograniczeń funkcjonalnych, a w konsekwencji na zmiany zwyrodnieniowe, które zwykle występują w torebce kostno-chrzęstnej i okołostawowej oraz więzadłach. Termin „T-OA” odnosi się do pierwszego stawu nadgarstkowo-śródręcznego (CMC-1), z lub bez stawu łopatkowo-ramiennego, rzadziej do stawu łopatkowo-ramiennego [3]. Oprócz bólu i zmienności upośledzenia czynnościowego ciężkość choroby określa się na podstawie radiograficznych stadiów Eatona i Littera. W odniesieniu do terapii, procedury niechirurgiczne mają na celu spowolnienie uszkodzeń anatomopatologicznych i opóźnienie opcji chirurgicznych. W tym celu zaproponowano leki, ortezy, zastrzyki ze sterydów lub innych substancji oraz fizykoterapię, ale nie wykazano wyższości żadnego z nich nad innymi [4]. Chirurgia sama w sobie daje różne wyniki i zachowuje kontrowersyjne zalety i wady zarówno pod względem czasu trwania wpływu na ból, jak i powrotu do sprawności funkcjonalnej [5].
Uzasadnienie stosowania ESW w kościach zaczyna się od pierwszego, udanego, systematycznego stosowania w opóźnionym zrostu i braku zrostu złamań [6] i naturalnie kontynuuje leczenie chorób naczyniowych, metabolicznych i zwyrodnieniowych. Fundamentalne badania na zwierzętach przeprowadzone przez Wang i wsp. wykazały, w jaki sposób leczenie kości podchrzęstnej (SB) było w stanie poprawić strukturę jednostki kostno-chrzęstnej (OU) wraz z pozytywnymi zmianami w biomarkerach OA i metabolizmu kości [7,8]. Ponadto, Znaczący pozytywny wpływ na ból zaobserwowano w OA kolana [9], a także w podchrzęstnym obrzęku szpiku kostnego (BME) [10], dysregulacji metabolicznej występującej w SB i często związanej z objawową OA. BME jest obecnie uważany za możliwą przyczynę strukturalnego i funkcjonalnego osłabienia OU, odzwierciedlającego zmiany w fizjologicznej wymianie między kością a chrząstką i z tego powodu jest czynnikiem predykcyjnym OA [11]. Dane kliniczne ujawniają skuteczność ESW również w artrozie kciuka [12] i na tej podstawie zaprojektowaliśmy zbiorcze badanie serii przypadków. W ten sposób chcieliśmy ocenić krótkoterminowy wpływ nowej technologii na ból. Technologia ta dostarcza impuls akustyczny, wykorzystując wpływ HI-LF-PEMF na materiały diamagnetyczne, uzyskując efekt odpychania zdolny do generowania tak zwanej „Diamagnetycznej Fali Uderzeniowej”. Ponadto naszym celem jest ocena, czy szybkie uderzenie mechaniczne wywołane przez pole magnetyczne o wysokiej intensywności na soczewkę akustyczną może być przyczyną dyskomfortu u leczonych pacjentów.
Metody
Od czerwca do grudnia 2020 r. włączyliśmy do badania serię 66 pacjentów (21 mężczyzn, 45 kobiet) w średnim wieku 63,28 lat (44-86 lat ± 10,32 SD) z artrozą kciuka w II-III stadium według klasyfikacji Eatona i Littera. Zostali oni poddani 3 sesjom leczenia ESWs, jedna na tydzień. Poziom energii wahał się od 0,09 do 0,11 mJ/mm2 gęstości strumienia energii (EFD) przy liczbie 120 impulsów na sesję na głębokości 2 cm ogniska. Pacjenci byli oceniani pod kątem bólu przed leczeniem i bezpośrednio po trzeciej sesji terapii falą uderzeniową. Zabiegi przeprowadzono w klinice Villa Gemma (Gardone Riviera - Włochy) oraz w Cell Regeneration Medical Organization (Bogota, Kolumbia). Kryteria włączenia do badania były następujące: wiek > 40 lat, ból w pierwszym stawie nadgarstkowo-śródręcznym (CMC) od co najmniej 6 miesięcy. Punkt odcięcia dla bólu ustalono na 4 punkty w skali VAS, podczas gdy stadium radiologiczne włączonych pacjentów musiało być zgodne z II - III stadium klasyfikacji Eaton i Litter. Do leczenia nie dopuszczono pacjentów z wcześniejszymi urazami, iniekcjami kortykosteroidów lub kwasu ialuronowego podawanymi w ciągu ostatnich trzech miesięcy. Wykluczono również uczestników, którzy mieli otrzymać fizykoterapię w tym samym przedziale czasowym badania. Pod uwagę wzięto zwykłe przeciwwskazania do leczenia ESW: ciąża, nowotwory złośliwe w obszarze docelowym (w tym przypadku skóra-kość) i ciężka koagulopatia.
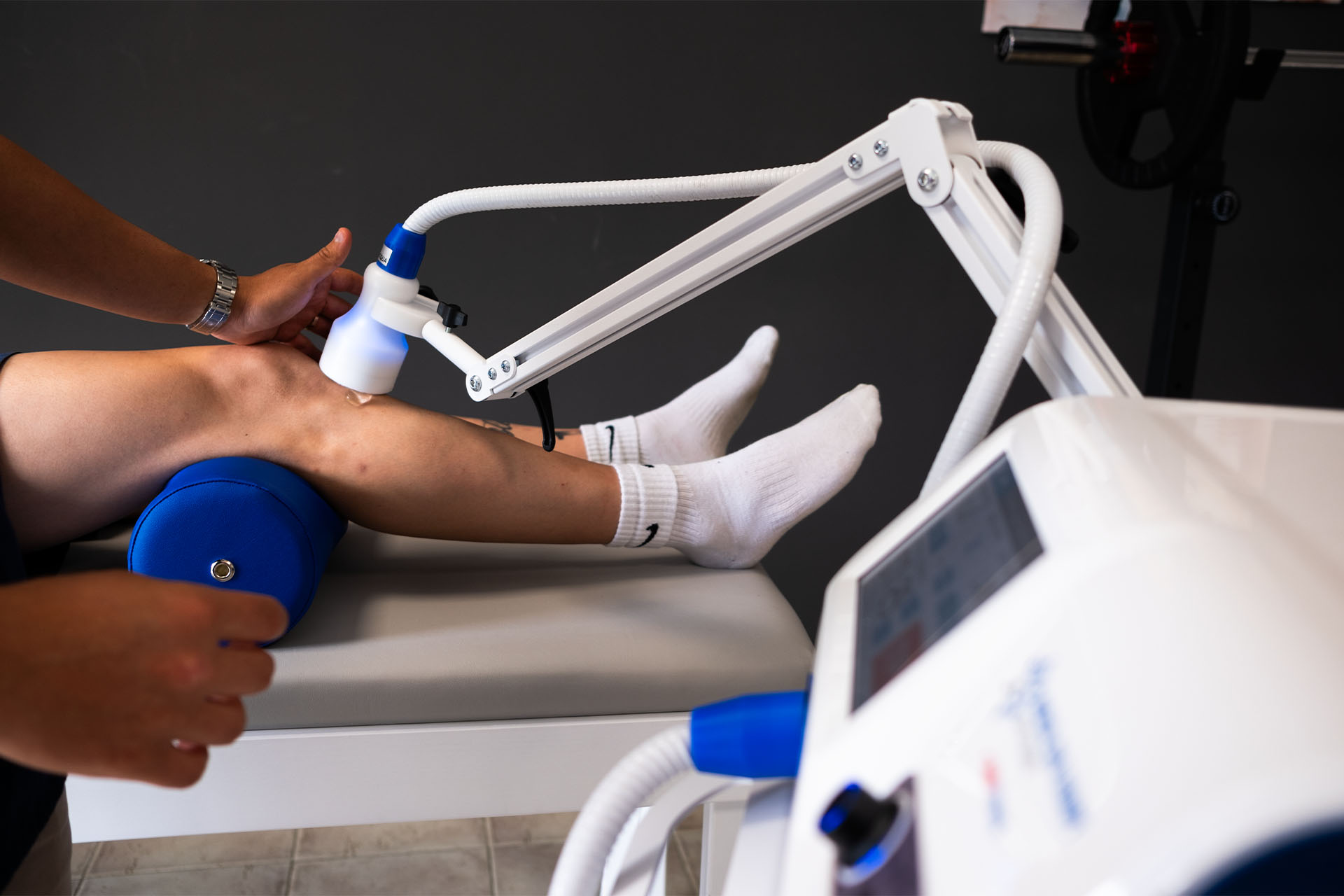
Urządzenie do terapii falą uderzeniową (CTU-S Wave® - Periso SA
Ze względu na właściwości substancji diamagnetycznych, po wystawieniu na działanie wysokich wartości pola magnetycznego, ulegają one silnemu i szybkiemu efektowi odpychania, zdolnemu do generowania fal ciśnienia o wysokiej energii (Diamagnetic Shock Wave). Ze względu na konieczność zapewnienia odpowiedniego czasu ładowania cewki elektromagnetycznej umieszczonej w rękojeści, częstotliwość impulsów w tym urządzeniu jest niska (16 Hz na minutę), ale jednocześnie zapewnia stały i stabilny poziom energii. Tarcza diamagnetyczna (soczewka diamagnetyczna) jest ukształtowana za pomocą szeregu pierścieni koncentrujących zgodnie z zasadą optyki Fresnela. Daje to możliwość modyfikacji soczewki sferycznej w soczewkę planarną bez zmiany jej właściwości optycznych (rysunek 2). Seria soczewek akustycznych, różniących się liczbą pierścieni, daje różną głębokość ogniskowania fali ciśnienia, od 2 do 6 cm. Protokół leczenia obejmował stymulację zarówno strony volar, jak i grzbietowej stawu CMC-1, skupiając energię akustyczną na kości trapezowej i podstawie pierwszej kości śródręcza. Dla każdego punktu podano 30 strzałów z łączną liczbą 120 impulsów przy niskiej częstotliwości (16 Hz / min) stymulacji. Jak już wyjaśniono, tak duże opóźnienie między dwoma kolejnymi strzałami jest konieczne, aby zapewnić optymalne naładowanie cewki elektromagnetycznej i stały poziom energii akustycznej dla ogólnej żywotności rękojeści urządzenia. W celu rozprowadzenia energii prostopadle, proksymalnie i dystalnie do stawu, ręka została ustawiona w pozycji neutralnej. Jako medium przewodzące zastosowano żel ultradźwiękowy (Complex Gel ®PerisoSA - Szwajcaria).

Rysunek 1: Rękojeść urządzenia CTU-S-Wave, w tym cewka elektromagnetyczna wewnątrz sondy i soczewka akustyczna. Fala uderzeniowa powstaje w wyniku szybkiego ruchu soczewki diamagnetycznej.
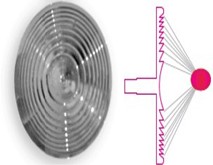
Rysunek 2: Soczewka diamagnetyczna. Akustyczna soczewka Fresnela jest soczewką wklęsłą uzyskaną przez rozkład soczewki wypukłej. Pozwala to na uzyskanie wysokiej rozdzielczości sygnałów akustycznych skupiających energię na określonej głębokości. Soczewki Fresnela są tworzone przez zestaw koncentrycznych pierścieni o malejącej szerokości: każdy pierścień jest nazywany „obszarem Fresnela”, a między dwoma kolejnymi obszarami występuje różnica faz p. Główny wkład energii w ogniskowanie jest zapewniany przez centralne obszary soczewki.
Analiza statystyczna wyników leczenia obejmowała sumę wyników przypisanych wszystkim pacjentom do oceny bólu w wizualnej skali analogowej (VAS) mierzonej przed leczeniem (T0) i pod koniec trzeciego leczenia (T1). Zebrane dane zostały przeanalizowane jako średnie wartości różnic ± odchylenia standardowe (SD) dla dyskretnych zmiennych liczbowych. Test „t” dla normalnego rozkładu danych został wybrany w celu określenia istotności statystycznej między okresem przed i po leczeniu oraz stratyfikacji ze względu na płeć i wiek, w tym przypadku poniżej i powyżej 60 lat. Poziom istotności został wybrany dla p< 0,05.
Wyniki
Wszyscy leczeni pacjenci wykazywali znaczny spadek bólu przez cały okres obserwacji w porównaniu z wartością wyjściową. Ocena bólu wykazała istotną statystycznie poprawę bólu przed i po leczeniu, bez istotnych różnic dla płci i wieku. VAS wahał się od 6,3 punktu przed leczeniem do 3,27 punktu pod koniec leczenia jako wartość średnia (SD ± 1,90 - P < 0,001) (ryc. 3, 4). Analiza stratyfikowana według wieku wykazała następujące średnie wartości zmienności VAS: 6,51 punktów przed leczeniem do 2, 93 punktów dla 29 próbek w wieku poniżej 60 lat (SD ±1,91 - P<0,001) w odniesieniu do zmiany od 6,62 do 3,5 punktów dla 37 próbek w wieku powyżej 60 lat (SD ±1,91 -P< 0,001). Średnia zmiana wartości bólu w zależności od płci wykazała odpowiednio 6,33 do 3,33 punktu przed leczeniem i po leczeniu dla mężczyzn (SD ± 2,42 - P<0,001) i 6,8 do 3,2 punktu dla kobiet (SD ± 1,63 - P<0,001). Wszyscy leczeni pacjenci byli w stanie ukończyć leczenie i nie zgłoszono żadnego bólu, dyskomfortu ani zdarzeń niepożądanych pomimo mechanicznego wpływu soczewki akustycznej.

Rycina 3: Grafika przedstawia reprezentację bezwzględnych częstotliwości (AF) na wynik VAS przed leczeniem i po leczeniu Diamagnetic Shock Wave (odcięta: wynik VAS. rzędna: liczba pacjentów na wynik VAS). AF przed leczeniem pokazuje linię pochyloną w prawo: wysokie wyniki VAS są częściej zgłaszane, z 7 jako trybem i medianą oraz 7,75-6 jako zakresem międzykwartylowym (górnym). Na wykresie AF po leczeniu (poniżej) linia jest bardziej nachylona w lewo; niższe wartości są zgłaszane z 2 jako tryb, 3 jako mediana i 5-2 jako zakres międzykwartylowy.
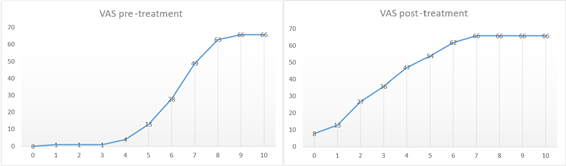
Rycina 4: Graficzne przedstawienie bezwzględnych skumulowanych częstości wyników VAS (CF) przed leczeniem i po leczeniu w podziale na wyniki VAS (odcięta: wynik VAS. rzędna: bezwzględne skumulowane częstości). Wynik przed leczeniem: najwyższe wyniki VAS są częściej zgłaszane, z 7 jako modą i medianą oraz 7,75-6 jako zakres międzykwartylowy (górny). Grafika CF po leczeniu pokazuje, że niższe wartości są częściej zgłaszane, z 2 jako modą, 3 jako medianą i 5-2 jako zakresem międzykwartylowym.
Dyskusja
Obecne koncepcje w zrozumieniu patogenezy OA podkreślają złożoność i wieloczynnikowy charakter choroby, w tym zmiany strukturalne całego stawu, które są przyczyną postępującej utraty funkcji [13]. Zaangażowanie kciuka ma niezwykły odsetek u kobiet (2 razy w stosunku do mężczyzn), głównie po menopauzie, gdzie radiologiczne dowody T-OA zaobserwowano u 36% kobiet [14].
Leczeniem pierwszego rzutu T-OA jest leczenie zachowawcze. Niemniej jednak nie wykazano dotychczas przewagi leków objawowych lub modyfikujących przebieg choroby, ortez, iniekcji do stawów i fizykoterapii, mających na celu spowolnienie postępu choroby. W niedawnej metaanalizie Aherna i wsp. stwierdzili, że istnieją wysokiej jakości dowody na to, że jednomodalne lub multimodalne leczenie fizykoterapeutyczne może skutkować klinicznie opłacalną poprawą bólu i funkcji u pacjentów z T-OA (np. zabiegi neurodynamiczne, stosowanie ortez, ultradźwięki, ćwiczenia bierne i terapia zajęciowa) [4]. Niemniej jednak, wcześniejsze leczenie niefarmakologiczne i silna motywacja pacjentów zostały uznane za czynniki predykcyjne do zabiegu chirurgicznego, który sam w sobie nadal nie oferowałby standaryzowanych technik lepszych od innych pod względem czasu trwania wpływu na ból i powrót do sprawności funkcjonalnej, korzyści lub szkód. Co więcej, porównanie z leczeniem nieoperacyjnym jest kontrowersyjne [5,15].
W ciągu ostatnich kilku dekad biofizyczna stymulacja uszkodzonej tkanki mięśniowo-szkieletowej zapewniana przez ESW rozprzestrzeniła się na całym świecie dzięki dużej różnorodności działań biologicznych. Obejmują one neoangiogenezę, produkcję czynników wzrostu, stymulację zróżnicowanych komórek do produkcji macierzy zewnątrzkomórkowej (ECM), a także bezpośrednie efekty regeneracyjne, w których pośredniczy aktywacja, naprowadzanie i różnicowanie mezenchymalnych komórek macierzystych [16]. Co więcej, bardziej wyrafinowane mechanizmy otwierają nowe horyzonty w zrozumieniu mechanizmu działania ESW, na przykład dostarczanie egzosomów i zmiana regulacyjna makrofagów w łączeniu stanu zapalnego i regeneracji tkanek [17-19]. Uzasadnienie leczenia OA za pomocą ESW zaczyna się od serii badań na zwierzętach, które wykazują skuteczność stymulacji kości podchrzęstnej we wczesnym stadium choroby. Zaobserwowano lepszy wynik chrząstki i dodatkowy wpływ na właściwości mechaniczne kości, a także wyższą ekspresję biomarkerów anabolicznych (osteokalcyna, białka morfogenetyczne kości) i niższą ekspresję biomarkerów katabolicznych (białko oligomeryczne chrząstki, metaloproteazy macierzy, telopeptyd II kolagenu) w wyniku leczenia ESW [8].
Oprócz typowych mechanizmów zapalenia, przyczynę bólu (bólu przewlekłego) w OA przypisuje się również rozregulowaniu neuropeptydów (NP), takich jak substancja P i peptyd związany z genem kalcytoniny (CGRP). Ich ekspresję zaobserwowano zarówno w zakończeniach nerwowych stawów zwyrodnieniowych, jak i w tylnych korzeniach odpowiedniego segmentu rdzenia kręgowego poprzez ortodromowe i antydromowe sposoby przekazywania bolesnych bodźców [20]. W eksperymentalnym modelu choroby zwyrodnieniowej stawu kolanowego leczenie ESW wykazało poprawę czasu trwania chodu, który odpowiadał redukcji liczby neuronów CGRP dodatnich [21]. Ponieważ wykazano, że neuropeptydy obniżają próg nocyceptorów w stawach zwyrodnieniowych [22], możemy lepiej rozważyć możliwą rolę ESW w leczeniu przewlekłego bólu stawów poprzez modulowanie produkcji NP. ESW są klasyfikowane jako mechanoterapia działająca poprzez mechanizm Mechanotransdukcji [23]. Zjawisko to odnosi się do przekładania bodźców mechanicznych na sygnały biologiczne, dzięki aktywacji mechanoczujników i wewnątrzkomórkowych szlaków mechano-sygnałowych. Występuje to, oprócz ESW, również w przypadku innych form mechanoterapii obejmujących mikroodkształcenia, ekspansję tkanek i osteogenezę dystrakcyjną [24]. Podstawową rolę w tych dobrze zorganizowanych procesach odgrywa ECM i jego zdolność do interakcji z komórkami. Ze względu na swoją naturę i strukturę, kość może łatwo reagować na bodźce mechaniczne, odkształcając się lub powodując lokalne naprężenia (mikro-naprężenia). W kości gradienty ciśnienia przepływają przez kostną strukturę beleczkową, rozciągając osteocyty i przemieszczając płyny pozakomórkowe. Łącznie, odkształcenia i przepływ płynu wywołują odpowiednio efekt piezoelektryczny i tworzenie strumieniowych potencjałów elektrycznych, które, jak zaobserwowano w hodowlach komórkowych, odgrywają kluczową rolę w mechanotransdukcji [25].
Uwalnianie energii akustycznej z urządzenia fali uderzeniowej zastosowanego w tym badaniu jest dość osobliwe. Wysoka energia (2T) generowana przez cewkę elektromagnetyczną wyładowuje się na akustycznej soczewce diamagnetycznej umieszczonej na zewnątrz rękojeści. Powoduje to szybki i wysokoenergetyczny naprzemienny ruch odpychający soczewki, który z kolei generuje skupioną falę akustyczną o wysokim ciśnieniu. Termin „diamagnetyczny” odnosi się do szczególnej właściwości magnetycznej materii, która w przeciwieństwie do ferromagnetyzmu ulega efektowi odpychania w obecności HI- LF- PEMF.
Sygnał akustyczny wytwarzany przez urządzenie przy 2 cm powierzchni ogniskowej (2,14 cm2) zapewnia maksymalną wartość (ciśnienie szczytowe) 42 MPa z zanikiem przy -6 dB mierzonym przy 21 MPa. Podciśnienie waha się od -6,87 MPa do -1,7 Mpa [dane dostarczone przez producenta urządzenia CTU-S-Wave® - Periso SA - Szwajcaria]. Częstotliwość impulsów jest niska (16 Hz na minutę), aby zapewnić odpowiedni czas ładowania cewki elektromagnetycznej podczas zabiegu. Ma to na celu zapewnienie stałego i stabilnego wysokiego natężenia pola magnetycznego, a w konsekwencji energii kinetycznej niezbędnej do poruszenia soczewki i wytworzenia Diamagnetycznej Fali Uderzeniowej. Ponadto, oprócz energii uwalnianej w obszarze ogniskowym, dodatkowy front energii mechanicznej wynika z uderzenia ukształtowanej dyskoidalnej soczewki (o średnicy 6 cm) w ciało. Generuje to poprzeczne fale ścinające (naprężenia ścinające) powstające w składowej sprężystej tkanek, przez które przechodzi fala akustyczna, przynosząc potencjalne bioefekty z transdukcji tego rodzaju sygnału mechanicznego [26]. W szczegółach, ruch płaskiej soczewki akustycznej urządzenia rozprowadza, oprócz odcinka osi długiej zogniskowanej fali uderzeniowej, fale poprzeczne, których kierunek jest normalny do osi długiej. Biorąc pod uwagę promień soczewki akustycznej (3 cm) i odległość ogniska (2 cm), można sobie wyobrazić teoretyczną cylindryczną objętość energii (56,6 cm3) otaczającą obszar ogniska, choć tłumioną wraz z odległością. Oznacza to możliwość dodatkowej energii dostępnej dla mechanotransdukcji sygnału akustycznego poza tą wynikającą z energii ogniskowej wytwarzanej przez soczewkę akustyczną. Odpowiednie pomiary powinny lepiej badać charakterystykę fal ścinających wytwarzanych przez maszynę.
Jednym z najbardziej interesujących tematów w fizyce akustycznej jest możliwość koncentracji, wynikająca z zasady optycznej Fresnela, sygnałów akustycznych o wysokiej rozdzielczości za pomocą zbieżnych jednoogniskowych soczewek planarnych utworzonych przez koncentryczne pierścienie o malejącej szerokości, znane jako płyty strefowe Fresnela (FZP) [27]. Te soczewki akustyczne skupiają dźwięk w taki sam sposób, jak soczewki optyczne skupiają światło; dzieje się tak, ponieważ podstawowa teoria ma zastosowanie zarówno do fal mechanicznych, jak i elektromagnetycznych. Na przykład jednym z zastosowań tych soczewek akustycznych w medycynie jest ablacja nowotworów za pomocą terapii zogniskowanymi ultradźwiękami o wysokiej intensywności (HIFU) [28]. Ogniskowa soczewka akustyczna dostarczana z urządzenia jest zgodna z projektem, parametrami, geometrią i wydajnością wymaganą dla płytki FZP (rysunek 2), zmieniając jedynie skład strukturalny i pierwotny za pomocą stopu diamagnetycznego. Coraz większa liczba badań klinicznych wykazuje skuteczność ESW w OA, głównie w kolanie. Uzasadnienie biologiczne opiera się na badaniach in vitro i in vivo. Wyniki dotyczące komórek chrzęstnych są kontrowersyjne. Moretti i wsp. zaobserwowali normalizację, na poziomie wewnątrzkomórkowym, ekspresji TNF-alfa i IL-10 w ludzkich chondrocytach stawowych pochodzących od pacjentów z chorobą zwyrodnieniową stawów [29]. Z drugiej strony zaobserwowano szkodliwe skutki przy wysokich energiach (0,5 mJ/mm2), nietypowych w praktyce klinicznej, takich jak ultrastrukturalne uszkodzenia retikulum endoplazmatycznego o szorstkiej powierzchni, oderwanie błony komórkowej i martwica chondrocytów w próbkach zwierzęcych [30]. Ważniejsza wydaje się rola SB nie tylko w patogenezie, ale także w leczeniu OA. Bardziej zadowalające wyniki uzyskali Wang i wsp. w badaniach na zwierzętach. Autorzy wykazali znaczącą poprawę oceny chrząstki, zwiększone stężenie chondrocytów i kolagenu typu II w surowicy, lepszą strukturę kości podchrzęstnej, produkcję markerów neoangiogennych i specyficznych czynników wzrostu kości, proliferację komórek [7,8].
Badania kliniczne donoszą o skuteczności ESW, zarówno w przypadku radialnej, jak i zogniskowanej fali uderzeniowej, w zmniejszaniu bólu i poprawie funkcjonalności zwyrodniałych stawów, co wynika z określonych wyników [31]. Korzystne wyniki opisano również w porównaniu z innymi terapiami, takimi jak ćwiczenia izokinetyczne i terapia ultradźwiękowa [32], podczas gdy odnotowano równoważne efekty między zabiegami radialnymi SW a dostawowymi iniekcjami kwasu hialuronowego, a także lepsze subiektywne i funkcjonalne wyniki w porównaniu z terapią laserową [33,34]. Wskazaniem do leczenia falami uderzeniowymi jest zwykle radiologiczne stadium Kallgrena i Lawrence'a w II-III stopniu zaawansowania. Niemniej jednak, podobnie jak w przypadku dużej części zastosowań klinicznych ESW, skrajna zmienność protokołów, intensywności, częstotliwości i wszystkich indywidualnych parametrów urządzeń oferowanych na rynku nie pozwala na zdefiniowanie jednorodnych procedur leczenia. W przypadku radialnych fal ciśnieniowych w leczeniu klinicznym choroby zwyrodnieniowej stawu kolanowego zaleca się umiarkowaną intensywność EFD (0,12 do0,25 mJ/mm2), a liczba uderzeń może być stosowana przy 2 000lub 4000 impulsów z podobnymi wynikami [35]. Podobnie, w przypadku zogniskowanych ESW, średnia dawka (EFD 0,09 mJ/mm2) byłaby bardziej skuteczna niż niższa (0,04 mJ/mm2) po 12 tygodniach po leczeniu, jak zgłoszono w odniesieniu do VAS, wyniku Rolesa i Maudsleya, wyniku WOMAC i wskaźnika Lequesne'a przy 1000 strzałów na zabieg [36]. Równie interesujący jest subiektywny i funkcjonalny wynik w nieciężkiej OA kolana (stadium K-L 1) w serii pacjentów po udarze mózgu, leczonych za pomocą1 000 impulsów tygodniowo przez 3 tygodnie z dawką energii 0,05 mJ/mm2 na proksymalnej przyśrodkowej kości piszczelowej chorego kolana [37].
Dlatego leczenie SB wydaje się być kluczem w leczeniu OA, biorąc również pod uwagę jego patogenetyczną rolę jako miejsca zaburzeń metabolicznych [10] i jednego z ognisk bólu aktywujących neurogenne zapalenie stawów [21,38]. Dzieje się tak, ponieważ czuciowe i współczulne włókna nerwowe i ich neuroprzekaźniki są neuronalnymi efektorami zdolnymi do regulowania patofizjologii chrząstki i kości oraz rezydentnych komórek układu kostno-stawowego, które mają receptory dla neuroprzekaźników współczulnych i czuciowych [39]. Podsumowując, przesłanki te prowadzą do wykorzystania leczenia ESW w innych lokalizacjach choroby, takich jak staw CMC-1. W RCT dotyczącym ESW w porównaniu z kwasem hialuronowym odnotowano, w dwóch seriach pacjentów z OA stawu CMC-1, znaczące zmniejszenie bólu, a poprawę wyników testu szczypania i zmniejszenie niepełnosprawności ręki przez co najmniej 6 miesięcy po leczeniu (2400 impulsów - 4 Hz częstotliwości - 0,09 mJ/mm2 EFD). W porównaniu z pacjentami leczonymi dostawowo kwasem hialuronowym, zmniejszenie bólu było prawdopodobnie większe w grupie ESWs; aspekt funkcjonalny był taki sam po 6 miesiącach od leczenia [12]. Nasze doświadczenie nie jest porównywalne z wyżej wymienionym. Nie jest to badanie kontrolowane i pomimo znacznej liczby pacjentów, ma pojedynczą kohortę kolejnych pacjentów, a ból po leczeniu jest jedynym wynikiem. Niemniej jednak badanie to miało na celu zbadanie pierwotnego wpływu na ból oryginalnej maszyny, która dostarcza skupione mechaniczne fale uderzeniowe (diamagnetyczne fale uderzeniowe) i, zgodnie z naszą wiedzą, jest to pierwsze badanie kliniczne z tym urządzeniem. Szczególną cechą tego badania jest wykorzystanie tych samych poziomów EFD stosowanych w innych badaniach nad OA, ale w przeciwieństwie do nich, z bardzo ograniczoną liczbą strzałów (nie więcej niż 120 impulsów na zabieg) niezbędnych do osiągnięcia korzystnego wyniku w zakresie bólu, jak wykazano w porównaniu przed i po leczeniu (p< 0,001). Zachowanie średnich wartości VAS było statystycznie niezależne od wieku i płci.
W tego typu urządzeniach, oprócz podłużnej składowej skupionej fali, poprzeczną składową energii można przypisać mechanicznemu ruchowi soczewki, który dostarcza dodatkową objętość energii, zgodnie z fizyką odkształcenia ścinającego o niskiej częstotliwości. W tych modelach efekty biologiczne uzyskane przez Mechanotransdukcję są bardziej związane z wynikowymi zmianami mechanicznymi (odkształceniami) w tkance niż z siłami, które powodują te zmiany (ilość energii zewnętrznej) [26]. W tym urządzeniu opisana powyżej rozpraszająca objętość energii wytwarzałaby te niewielkie siły poprzeczne (odkształcenie ścinające), aby uzyskać efekty biologiczne w uzupełnieniu do tych pochodzących ze skupionej energii akustycznej. Podsumowując, dwumodalne dostrajanie energii akustycznej dostarczanej przez maszynę CTU-S-Wave obejmuje obie zmiany EFD, jak ma to miejsce w przypadku wszystkich maszyn SWs, podczas gdy natężenie pola magnetycznego, które wpływa na soczewkę diamagnetyczną, generuje rozpraszającą objętość energii otaczającą obszar ogniskowy, w którym dominuje składowa poprzeczna. Soczewka akustyczna jest soczewką Fresnela, wklęsłą soczewką otrzymaną przez rozkład soczewki wypukłej. Pierwotnie została stworzona do ogniskowania fal elektromagnetycznych, a następnie została rozszerzona na fale akustyczne. Jest skuteczna w skupianiu energii akustycznej w określonym obszarze na określonej głębokości, spełniając różne bieżące potrzeby leczenia zaburzeń mięśniowo-szkieletowych. Soczewki Fresnela składają się z zestawu koncentrycznych pierścieni o malejącej szerokości: każdy pierścień nazywany jest „obszarem Fresnela”, a między dwoma kolejnymi obszarami występuje różnica faz π [27]. Główny wkład energii w ogniskowanie jest zapewniany przez centralne obszary soczewki, a różna liczba pierścieni zapewnia ogniskowanie na różnych głębokościach. Możemy uzyskać lepszą wydajność ogniskowania w zależności od materiału, z którego wykonana jest soczewka, który minimalizuje współczynnik odbicia i ma duże niedopasowanie impedancji do ośrodka macierzystego (stop diamagnetyczny).
Efekt diamagnetyczny wywodzi się z siły magnetycznej i momentu magnetycznego pochodzących z dobrze zdefiniowanej energii magnetycznej na poziomie ultrastrukturalnym materii diamagnetycznej [40,41]. Oznacza to, że wysokie natężenia pola magnetycznego pola magnetycznego są konieczne, aby skierowana w górę przeciwna siła diamagnetyczna mogła poruszyć soczewkę diamagnetyczną, wytwarzając falę uderzeniową w sposób mechaniczny. Uderzenie mechaniczne może aktywować mechanowrażliwe kanały jonowe w mechanowrażliwych nerwach doprowadzających i może powodować dyskomfort lub ból u pacjentów. Niemniej jednak, ponieważ rosnący rozmiar źródła stymulującego zmniejszyłby naprężenia ścinające w pobliżu źródła dla danej amplitudy, w tym urządzeniu większy obszar soczewki akustycznej (36 cm2) pozwala uniknąć zakłóceń dla pacjentów podczas leczenia falą uderzeniową, zgodnie z reaktywnością mechaniczną dużej części komórek ludzkiego ciała na zewnętrzne bodźce mechaniczne [42].
Przenosząc te koncepcje na charakterystykę urządzenia, można dokonać pewnych rozstrzygających rozważań:
- Kształt soczewki akustycznej pozwala na skupienie energii akustycznej na różnych poziomach energii;
- Większa powierzchnia soczewki (36 cm2), choć poddawana wysokim naprężeniom mechanicznym niezbędnym do wytworzenia fali uderzeniowej, zmniejsza naprężenia ścinające w pobliżu źródła i zapobiega nadmiernej stymulacji zakończeń nerwów skórnych;
- Oprócz zogniskowanej fali uderzeniowej, ruch soczewki wytwarza objętość (56,6 cm3) dodatkowej energii tłumiącej o potencjalnych skutkach biologicznych, generowanej przez poprzeczne powolne fale, które generują fizjologiczne naprężenia ścinające.
Koncepcje te powinny częściowo wyjaśniać brak bólu i dyskomfortu zgłaszanego przez pacjentów podczas zabiegów, a ponadto pewna liczba z nich nie odczuwała wpływu soczewki akustycznej na skórę, pomimo impulsu mechanicznego. Hipoteza ta wymagałaby dalszych i szczegółowych badań.
Wnioski
Zebraliśmy szereg danych dotyczących leczenia T-OA za pomocą oryginalnego zogniskowanego urządzenia ESWs (CTU-S-Wave). Zaobserwowaliśmy znaczącą poprawę bólu przed i po leczeniu, niezależnie od wieku i płci pacjentów. Co charakterystyczne, pomimo wysokoenergetycznego ruchu soczewki, pacjenci nie zgłaszali żadnych skutków ubocznych, w tym bólu lub dyskomfortu, a także percepcji impulsu mechanicznego.
Podziękowania : Dr S. Pisani za wsparcie epidemiologiczne i statystyczne.
Bibliografia
1. Brent B. P. Kyle, R. Eberlin (2019) Zapalenie stawów podstawy kciuka. Clin Plastic Surg 46: 407-413.
2. Zhang Y, Niu J, Kelly-Hayes M, Chaisson CE, Aliabadi P, et al. (2002) Częstość występowania objawowej choroby zwyrodnieniowej stawów rąk i jej wpływ na stan funkcjonalny wśród osób starszych: badanie Framingham. Am J Epidemiol 156: 1021e7.
3. M Kloppenburg, S. van Beest Feline P.B. Kroon (2017) Thumb base osteoarthritis: Podzbiór choroby zwyrodnieniowej stawów rąk wymagający odrębnego podejścia. Best Practice & Research Clinical Rheumatology 31: 649- 660.
4. M. Aherna, J. Skyllasb, A. Wajonc, J. Husha (2018) Skuteczność terapii fizykalnych u pacjentów z chorobą zwyrodnieniową podstawy kciuka: przegląd systematyczny i metaanaliza. Nauka i praktyka o układzie mięśniowo-szkieletowym 35: 46-54.
5. Wajon A, Vinycomb T, Carr E, Edmunds I, Ada L (2015) Chirurgia choroby zwyrodnieniowej stawów kciuka (stawu trapezowo-śródręcznego). Baza danych przeglądów systematycznych Cochrane 2015.
6. P. Romeo i wsp., V. Lavanga, D. Pagani, V (2014) Sansone Pozaustrojowa terapia falą uderzeniową w zaburzeniach mięśniowo-szkieletowych: przegląd. Med Princ Praktyka 23: 7-13.
7. C.J. Wang, Yi-c. Sun, Ka-Kit Siu, Cheng-Ta Wu (2013) Pozaustrojowa terapia falą uderzeniową wykazuje działanie specyficzne dla miejsca w chorobie zwyrodnieniowej stawu kolanowego u szczurów. Dziennik badań chirurgicznych 183: 612-619.
8. C. J. Wang1, Jai-H. Cheng1, Chien-Yiu Huang, S.L. Hsu, F.Y. Lee i in. (2017) Kość podchrzęstna piszczeli przyśrodkowej jest kluczowym celem pozaustrojowej terapii falą uderzeniową we wczesnej chorobie zwyrodnieniowej stawu kolanowego. Jestem. J.Tłum. Rez. 9: 1720-1731.
9. Zhao Z, Jing R, Shi Z, Zhao B, Ai Q i in. (2013) Skuteczność pozaustrojowej terapii falą uderzeniową w chorobie zwyrodnieniowej stawu kolanowego: randomizowane badanie kontrolowane. J Surg. Rez. 185: 661-666.
10. V. Sansone, E. Maiorano, V. Pascale, P. Romeo (2019) Uszkodzenia szpiku kostnego stawu kolanowego: podłużna korelacja między zmianami wielkości zmian a bólem przed i po leczeniu zachowawczym pozaustrojową terapią falą uderzeniową. European Journal of Physical and Rehabilitation Medicine 55: 225-230.
11. T. Alliston, C.J Hernandez, D.M. Findlay, DT Felson, OD Kennedy (2018) Uszkodzenia szpiku kostnego w chorobie zwyrodnieniowej stawów, co się kryje pod nimi. Journal of Orthopaedic 36: 1818-1825.
12. F. Ioppolo, F. Saracino, R. S. Rizzo, G. Monacelli, D. Lanni i in. (2018) Porównanie między pozaustrojową terapią falą uderzeniową a dostawowymi zastrzykami kwasu hialuronowego w leczeniu choroby zwyrodnieniowej pierwszego stawu nadgarstkowo-śródręcznego Med 42: 92-100.
13. R. F. Loeser, S. R. Goldring, C. R. Scanzello, M. B. Goldring MB (2012) Choroba zwyrodnieniowa stawów: choroba stawu jako narządu. Zapalenie stawów Rheum 64: 1697e707.
14. Sonne -Holm S, Jacobsen S (2006) Choroba zwyrodnieniowa stawów pierwszego stawu nadgarstkowo-śródręcznego: badanie radiologii i epidemiologii klinicznej. Wyniki badania kopenhaskiego dotyczącego choroby zwyrodnieniowej stawów. Choroba zwyrodnieniowa stawów chrząstka 14: 496-500.
15. Gravås EMH, Østerås N, Nossum R i in. (2019) Czy terapia zajęciowa opóźnia lub zmniejsza odsetek pacjentów poddawanych operacji stawu śródręczno-nadgarstkowego kciuka? Wieloośrodkowe, randomizowane, kontrolowane badanie. RMD Open 2019;5: e001046.
16. Aicher, C. Heeschen, K.-Ichiro Sasaki, C. Urbich. A. M. Zeiher, S. Dimmeler (2006) Niskoenergetyczna fala uderzeniowa w celu zwiększenia rekrutacji śródbłonkowych komórek progenitorowych Nowa metoda zwiększania skuteczności terapii komórkowej w przewlekłym niedokrwieniu kończyn tylnych. Obieg 114: 2823-2830.
17. D. Lobenwein, Can G. Tepekeoylu, R. Kozaryn, J. Pechriggl, M. Bitsche i in. (2015) Holfelda. Leczenie falą uderzeniową chroni przed zwyrodnieniem neuronów za pośrednictwem mechanizmu zależnego od receptora Toll-like 3: implikacje pierwszego w historii leczenia przyczynowego niedokrwiennego uszkodzenia rdzenia kręgowego. J. Am Heart Assoc 4: e002440.
18. Can Gollmann-Tepeköylü i in. (2020) miR-19a-3p zawierający egzosomy poprawia funkcję niedokrwionego mięśnia sercowego po terapii falą uderzeniową Cardionaczyniowe Research 116: 1226-1236.
19. N. G. Sukubo, E. Tibalt, S. Respizzi, M. Locati, M. C. d’ Agostino (2015) Wpływ fal uderzeniowych na makrofagi: możliwa rola w regeneracji i przebudowie tkanek. International Journal of Surgery 24: 124-130.
20. Fernihough J, Gentry C, Bevan S, Winter J (2005) Regulacja peptydu związanego z genem kalcytoniny i TRPV1 w szczurzym modelu choroby zwyrodnieniowej stawów. Neurosci Lett 388: 75-80.
21. N. Ochiai, S. Ohtori T. Sasho, K. Nakagawa K. Takahashi, N. Takahashi i in. (2007) Pozaustrojowa terapia falą uderzeniową poprawia dysfunkcję motoryczną i ból wynikający z choroby zwyrodnieniowej stawu kolanowego u szczurów. Choroba zwyrodnieniowa stawów i chrząstki 15: 1093-1096.
22. T. A. Nees, N Rosshirt. T. Reiner, M. Schiltenwolf, B. Moradi i in. (2019) Zapalenie i ból związany z chorobą zwyrodnieniową stawów [artykuł w języku niemieckim]. Schmerz 33: 4-12.
23. MC d’Agostino, K. Craig, E. Tibalt. Respizzi (2015) Fala uderzeniowa jako biologiczne narzędzie terapeutyczne: od stymulacji mechanicznej do regeneracji i gojenia, poprzez mechanotransdukcję. International Journal of Surgery 24: 147e153.
24. C. Huang, J. Holfeld, W. Schaden, D. Orgill, R. Ogawa (2013) Mechanoterapia: powrót do fizjoterapii i rekrutacja mechanobiologii na nową erę w medycynie. Trendy w medycynie molekularnej, 19 września: 555-564.
25. C. H. Turner, F. M. Pavalko (1998) Mechanotransdukcja i odpowiedź funkcjonalna szkieletu na stres fizyczny: mechanizmy i mechanika adaptacji kości. J. Orthop Sci 3: 346-355.
26. E. L. Carstensen, K. J. Parker, D. Dalecki, D.C. Hocking (2016) Biological Effects of Low Frequency Shear Strain. Część 1.- Deskryptory fizyczne. USG Med Biol 42: 1-15.
27. S. P. López, J. M. Fuster, P. Candelas, D. T.-Serrano, S. C.-Ibáñez i in. (2020) Dwuogniskowe ogniskowanie ultradźwiękowe przy użyciu soczewek dwustrefowych Fresnela. Czujniki 2020.
28. D. T.-Serrano, S. P. López, P. Candelas, A. Uris, C. Rubio (2019) Wzmocnienie ostrości akustycznej w soczewkach płytowych strefy Fresnela. Raporty naukowe 9: 7067.
29. B. Moretti, F. Iannone, A. Notarnicola, G. Lapadula, L. Moretti i in. (2008) Pozaustrojowe fale uderzeniowe regulują w dół ekspresję interleukiny-10 i czynnika martwicy nowotworu alfa w chondrocytach z chorobą zwyrodnieniową stawów. BMC Zaburzenia mięśniowo-szkieletowe 9:16.
30. S. Mayer-Wagner, J. Ernst, M. Maier, M Chiquet, H. Joos i in. (2010) Wpływ wysokoenergetycznych pozaustrojowych fal uderzeniowych na chrząstkę szklistą dorosłych szczurów in vivo. J Orthop Res. 28: 1050-1056.
31. Qiaodan Ji, Pu Wang, Chengqi He (2016) Pozaustrojowa terapia falą uderzeniową jako nowe i potencjalne leczenie chorób zwyrodnieniowych chrząstki i kości: choroba zwyrodnieniowa stawów. Jakościowa analiza literatury. Postęp w biofizyce i biologii molekularnej 121: 255-265.
32. Chen, T.-W., Lin, C.-W., Lee, C.-L., Chen, C.-H., Chen, Y.-J i in. (2014) Skuteczność terapii falą uderzeniową u pacjentów z chorobą zwyrodnieniową stawu kolanowego i cyamellą podkolanową. Kaohsiung J. Med. Sci 30: 362-370.
33. J.-K. Lee, B.Y. Lee, W-Yong Shin, Min-Ji An, K-Ik Jung i in. (2017) Wpływ pozaustrojowej terapii falą uderzeniową w porównaniu ze śródstawowymi zastrzykami kwasu hialuronowego w leczeniu choroby zwyrodnieniowej stawu kolanowego. Anna Rehabilitacja. Med 41: 828-835.
34. Wei Li, Yu Pan, Qi Yang, Zheng-Gui Guo, Qi Yue i in. (2018) Pozaustrojowa terapia falą uderzeniową w leczeniu choroby zwyrodnieniowej stawu kolanowego. Badanie retrospektywne. Medycyna 97: e11418.
35. Ya-Fei Zhang, Yang Liu, Shao-Wen Chou, Hao Weng (2021) Zależne od dawki skutki terapii radialną falą uderzeniową w chorobie zwyrodnieniowej stawu kolanowego: randomizowane badanie kliniczne. J Rehabil Med 53: 00144.
36. Jin-H. Kim, Ja-Y. Kim, Cheol-Min Choi, czerwiec-K. Lee, Hoi-Sung Kee i in. (2015) Zależne od dawki skutki pozaustrojowej fali uderzeniowej Terapia choroby zwyrodnieniowej stawu kolanowego. Ann Rehabil Med 39: 616-623.
37. Sung J. Cho, Ja R. Yang, Hee S. Yang, Hea-E. Yang (2016) Terapia u pacjentów z przewlekłym udarem mózgu i chorobą zwyrodnieniową stawu kolanowego: badanie pilotażowe. Ann Rehabil Med 40: 862-870.
38. D. A. Walsh, Paul I. Mapp, S. Kelly (2015) Peptyd związany z genem kalcytoniny w stawie: wkład w ból i stan zapalny. Br J Clin Pharmacol 80: 965-978.
39. S. Grässel, D (2017) Muschter Obwodowe włókna nerwowe i ich neuroprzekaźniki w patologii choroby zwyrodnieniowej stawów. Wewnętrzne J. Mol. Nauka 931.
40.M. Yamato, T. Kimura (2020) Magnetyczne przetwarzanie materiałów diamagnetycznych. Polimery (Bazylea) 12: 1491.
41. R. Jackson (2015) John Tyndall i wczesna historia diamagnetyzmu. Annals of Science 72: 435-489.
42. KO Johnson (2001) Role i funkcje mechanoreceptorów skórnych. Aktualny Opinia. Neurobiol 11: 455-461.
&a